Farmacéutica Pfizer solicitó autorización de emergencia a la UE
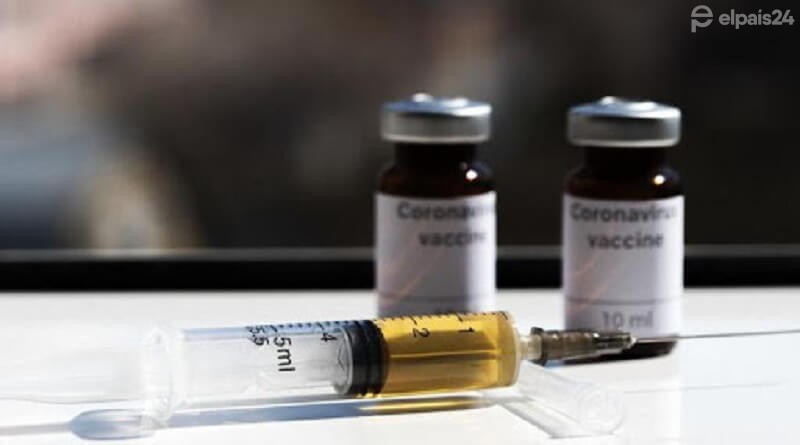
Farmacéutica Pfizer solicitó autorización de emergencia a la Unión Europea para su vacuna contra el covid-19. Mientras el mundo espera con ansias la vacuna, Pfizer planea introducirla al mercado europeo. Luego de publicar los resultados de sus pruebas que dieron 95 % de efectividad, apunta a lanzar su vacuna en el continente para antes de fin de año.
La empresa estadounidense Pfizer es un laboratorio líder a nivel mundial en el sector farmacéutico. Se dedica al desarrollo de medicamentos y vacunas. Su sede central está en la ciudad de New York.
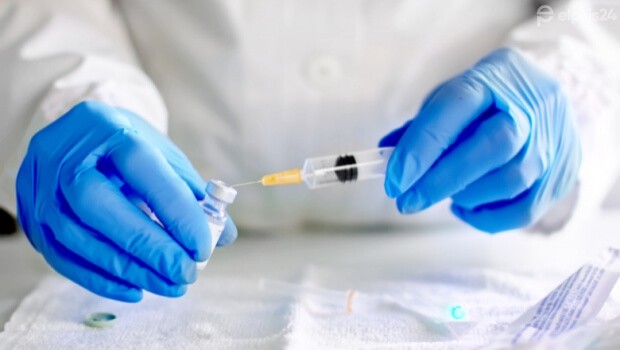
En marzo de 2020 comenzó a desarrollar una vacuna contra el covid-19, para poder ayudar a poner fin a la pandemia mundial provocada por el coronavirus. Para ello se asoció con otro gigante farmacéutico, BioN Tech, con sede en Alemania. En el mes de julio comenzaron ya sus fase tres de pruebas en humanos y solicitaron a la FDA (Asociación de medicamentos y alimentos de los EEUU) la designación de vía rápida.
En noviembre de 2020 la empresa anunció que su vacuna ofrecía más del 90 % de efectividad, noticia que recorrió el mundo y aumentó las esperanzas de terminar con la gran crisis sanitaria. Hoy el coronavirus sigue azolando los continentes y ya dejó la escalofriante suma de más de 63 millones de contagiados y un millón y medio de muertos.
Autorización de emergencia en la Unión Europea
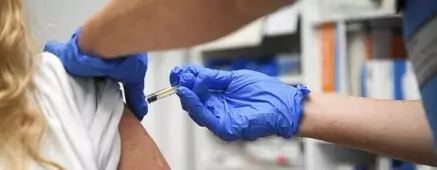
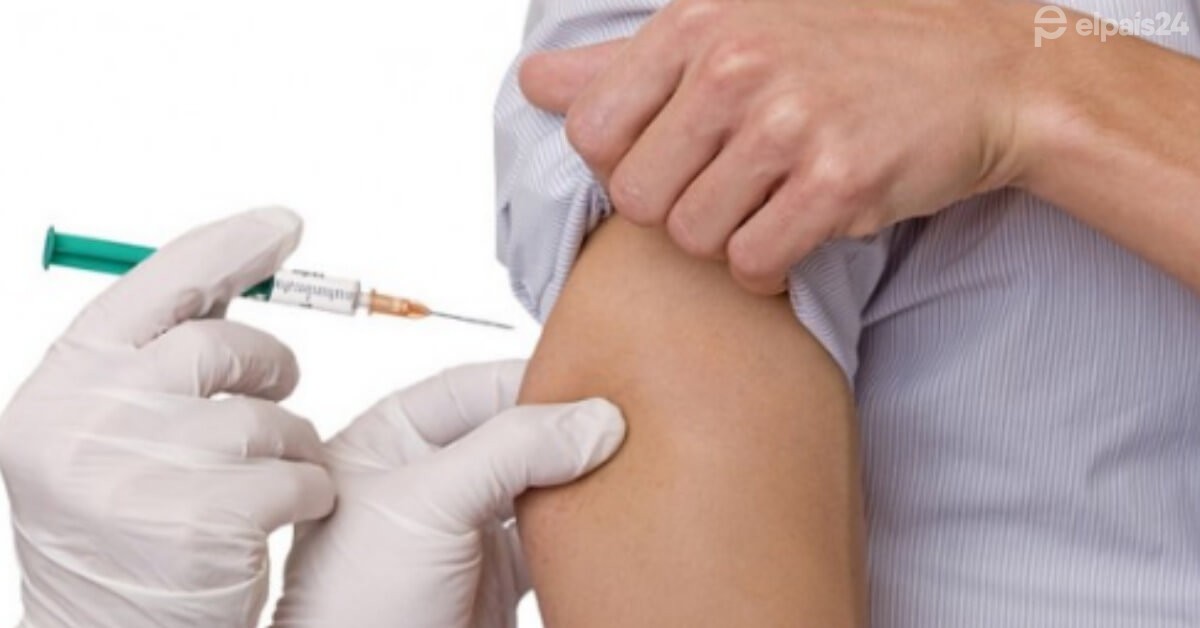
La vacuna hoy se vislumbra como la única esperanza para volver a a normalidad. El 20 de noviembre, la farmacéutica Pfizer pidió autorización de emergencia a la FDA en Estados Unidos. Este martes, Pfizer y su socio BioN Tech anunciaron el pedido de aprobación regulatoria de la Unión Europea para su vacuna BNT162b2 para Covid-19. La solicitud fue presentada a la Agencia Europea de Medicamentos (EMA) para una autorización condicional de comercialización, luego de presentar su 95 % de efectividad. Si obtuvieran la autorización, podrían lanzar su vacuna en el viejo continente para antes de fin de año.
Una autorización de emergencia significa que la EMA puede otorgar una autorización con menos datos que los solicitados en situaciones normales. Cuando hay razones de interés público, los datos solicitados son menos exhaustivos. Sin embargo, hay una serie mínima de requisitos que se deben cumplir. El primero, que haya un balance positivo entre beneficio y riesgo. Además, que haya un beneficio para la salud pública y que se puedan satisfacer las necesidades médicas con una disponibilidad inmediata de los productos.
La empresa Pfizer señaló también que están dispuestos a distribuir la vacuna en todo el mundo para poder terminar con este gran flagelo que cambió nuestras vidas para siempre.